Amigos da AME-RIO,
Ontem, ao responder uma mensagem do Pedro Paulo Peixoto, nosso ex-presidente, a respeito da tragédia que se abateu sobre a região serrana do Rio de Janeiro, a Dra. Vera Lúcia Imperatriz-Fonseca lembrou que depois do auxílio necessário aos atingidos pela catástrofe climática, haverá ainda a necessidade de se unir forças para a recuperação da área afetada, principalmente com relação a vegetação. Aproveitou para mencionar “uma grande campanha para o plantio de 1 milhão de árvores para as abelhas no Brasil”, a qual ela está patrocinando.
A Dra. Vera Lúcia é professora do Instituto de Biologia da Universidade de São Paulo e do Instituto de Estudos Avançados da Universidade de São Paulo (IB-IEA/USP), e atualmente na UFERSA, em Mossoró-RN. A pesquisadora é uma das coordenadoras do trabalho "Avaliação do Uso Sustentável e Conservação dos Serviços Ambientais Realizados pelos Polinizadores no Brasil", em fase de conclusão, em parceria com o Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq). O levantamento tem por objetivo, otimizar a produção de alimentos, bio-combustíveis e a conservação da biodiversidade, por meio de serviços de polinizadores.
A Dra. Vera Lúcia também aproveitou para nos brindar com um trabalho de Sidnei Mateus, publicado no volume 100 da revista Mensagem Doce, intitulado: “Locais de Nidificação das Abelhas Nativas sem Ferrão (Hymenoptera, Apidae, Meliponinae) do Parque Municipal do Bacaba, Nova Xavantina – MT”, sobre árvores que podem oferecer ocos para as abelhas.
Enviou também um outro artigo, do mestre Paulo Nogueira Neto, publicado nesse mesmo volume: “Árvores para as abelhas e para aves”.
O Pedro Paulo expressou seu desejo que esses dois artigos fossem colocados no Blog, para facilidades de acesso de nossos associados e eu resolvi atendê-lo.
Atendendo ao Pedro Paulo, mas mudando um pouco, coloquei nessa postagem o link para os artigos, basta clicar no nome do artigo ou no nome do Autor, ali em cima, e você verão o artigo completo.
E nessa postagem vou colocar um artigo de Marilda Cortopassi-Laurino, Denise de Araujo Alves e Vera Lucia Imperatriz-Fonseca sobre o mesmo assunto .
Uga,
José Halley Winckler

Simpósio sobre Associativismo em Meliponicultura, vendo-se na mesa os participantes: Renato Bochiccio, Pedro Paulo Peixoto, Paulo Nogueira Neto, Vera Lúcia I.Fonseca, Marilda Cortopassi-Laurino, Alexandre J.Moura e Raimundo Vidarico do Nascimento.
Artigo
ÁRVORES NEOTROPICAIS, RECURSOS IMPORTANTES PARA A NIDIFICAÇÃO DE ABELHAS SEM FERRÃO (APIDAE, MELIPONINI)
Marilda Cortopassi-Laurino, Denise de Araujo Alves e Vera Lucia Imperatriz-FonsecaLaboratório de Abelhas, Depto de Ecologia. IBUSP São Paulo. mclaurin@usp.br
Introdução
As abelhas em ferrão são insetos abundantes das regiões tropicais e subtropicais e que vivem em colônias de centenas a milhares de abelhas, dependendo da espécie. Estas colônias são perenes e a maioria nidifica em troncos de árvores, algumas em termiteiros, no solo e outras ainda constroem ninhos expostos ou em construções humanas (Hubbell & Johnson 1977).
Embora exista grande diversidade de locais para nidificação, um levantamento feito por Roubik (1983) no Panamá encontrou 40 espécies de Meliponini, das quais 27 nidificavam em cavidades de árvores, 5 em ninhos de formigas, 4 no solo e 4 construíam ninhos expostos. De todas estas espécies, 9 nidificavam também em construções humanas. Outros locais menos comuns foram relatados recentemente: Trigona cilipes nidificando em ninho de vespa (Rasmussem, 2004) e um caso de Frieseomelitta portoi nidificando no interior de um cipó morto que tinha comprimento de 12cm (Kerr et al. 1967).
A ocorrência de ocos nas árvores está relacionada com a queda de galhos causada por ventos, raios, cipós, idade, fogo, e ataque de insetos como cupins, larvas de besouros, fungos, bactérias, abertura de clareiras e poda natural de galhos mais baixos. (Gibbons & Lindenmayer, 1997; Nogueira & Nelson 2003). Injúrias no cerne das árvores podem permitir a entrada de fungos que por sua vez, facilitam a entrada de cupins e outros insetos.
A presença de árvores com ocos é importante nos planos de manejo das florestas. Estes ocos, muitas vezes, depreciam o valor econômico das madeiras. Entretanto, a presença de oco é de bom valor econômico quando acumula óleos ou bálsamos, alguns de importância comercial como o óleo de copaífera (Copaifera reticulata e Cassia multijuga), copaíba-jacaré (Eperua oleifera) e inamui (Ocotea barcelllensis) segundo Rodrigues & Valle (1964).
A ocorrência de ocos e também o seu formato afetam diretamente a estimativa do volume de madeira da floresta e o da emissão de gases de efeito estufa de determinada região (Nogueira et al., 2006). Troncos ocos têm ainda grande valor regional, especialmente entre o elemento indígena na confecção de canoas e instrumentos de percussão e comunicação (Rodrigues & Valle 1964).
Recentemente, a presença de ocos nas árvores tem sido considerada um fator de manutenção da biodiversidade, visto que muitos animais como aves e pequenos mamíferos, utilizam estes espaços como abrigo ou para nidificação (Harper et al., 2005), e como regra geral é sugerido que pelo menos 30 ocos por hectare são necessários para suportar um rica fauna, embora este valor possa variar com tipo de ambiente e número de espécies selvagens.
Relacionado com as espécies disponíveis em floresta seca tropical da Costa Rica (Guanacaste), Hubbell & Johnson (1977), verificaram que as abelhas ocupavam só 25 das 74 cavidades em árvores ou seja, 34%. Na região de caatinga, Castro (2001) observou que os meliponíneos utilizaram 10 espécies arbóreas e arbustivas, que corresponderam a 32.3% das espécies vegetais disponíveis com ocos (n=31).
Acredita-se que cada espécie de abelha necessite de um diâmetro mínimo de para a construção do favo, o que não acontece para o diâmetro máximo. Hubbel & Johnson (1977), encontraram 25cm para N. testaceicornis, 33cm para T. pectoralis, T. fuscipennis e T.dorsalis e 46cm para T.capitata. Darchen (1972) relatou que colônias são raramente encontradas em árvores com diâmetro menor que 10cm nas savanas da Costa do Marfim, o mesmo valor que Martins et al. (2003), encontraram como diâmetro mínimo ocupado por abelhas na região de caatinga.
Com o objetivo de catalogar as espécies de árvores com ocos que algumas espécies de abelhas sem ferrão usam como local de nidificação, foi realizado um levantamento bibliográfico destas informações, acrescentado de observações pessoais feitas em várias regiões do Brasil. A tendência de maior uso de algumas espécies botânicas para ninhos de meliponíneos foi avaliada, assim como algumas características como diâmetro, altura do ninho, ninhos compartilhados e volume dos ocos utilizados por algumas espécies.
Material e Métodos
Foi realizada uma revisão bibliográfica onde foram encontradas informações sobre vinte espécies de abelhas sem ferrão e respectivas espécies de árvore que usavam para construir seu ninho, assim como o ecossistema onde se encontravam, totalizando 716 informações. As árvores foram identificadas através das flores, do nome popular e visualmente por meio de catálogos de identificação como os de Lorenzi, (1992;1998) e Proença et al., (2006). Destas espécies botânicas, quando possível, foi anotado se eram exemplares vivos ou mortos. O diâmetro das árvores e a altura da entrada do ninho foram medidos assim como o volume do oco por ocasião de algumas transferências de abelhas do gênero Melipona.
Resultados
As árvores identificadas usadas por meliponíneos para nidificação (n=716) em ocos estão associadas com 56 famílias botânicas, onde predominaram as Fabaceae, Anacardiaceae, Bignoniaceae, Moraceae, Vockysiaceae e Burseraceae (Fig.1). Os gêneros botânicos (n=71) mais freqüentes foram Tabebuia, Caesalpinia, Salvertia, Commiphora e Ficus (Fig.2). Na literatura, assim como nas nossas observações, as espécies de árvores vivas predominaram sobre as de árvores mortas.
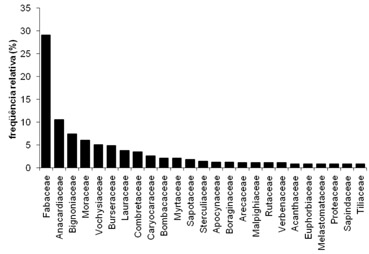
Fig. 1 Famílias botânicas mais observadas com ninhos de Meliponini no oco das árvores
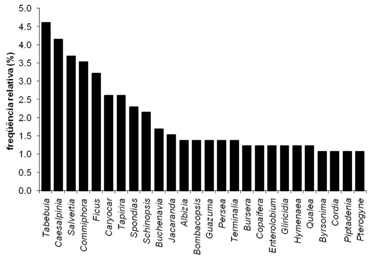
Fig. 2 Gêneros botânicos mais observados com ninhos de Meliponini no oco das árvores
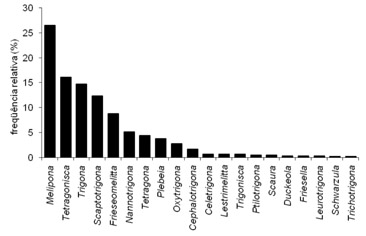
Fig. 3 Gêneros de abelhas Meliponini mais amostrados nidificando em ocos de árvores

Os ninhos da abelha irapuá (T.spinipes n=17) são aéreos construídos em forquilhas de árvores; foram localizados na altura média de 7.4m (3-15m) e principalmente em Chorisia speciosa (Bombacaceae) em áreas urbanas. (Tab.2). A maioria destas espécies apresenta caducifolia.
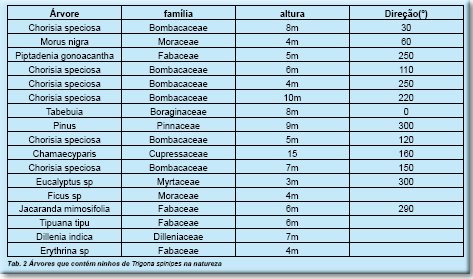
A altura da entrada do ninho e o diâmetro da respectiva árvore indicam que eles variam desde 0.5-3.0m e de 24-61cm respectivamente. (Tab.3)
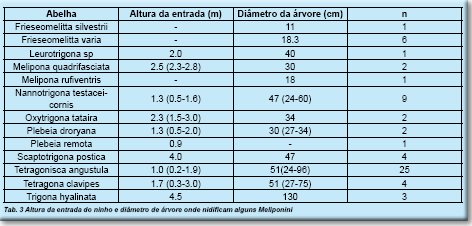
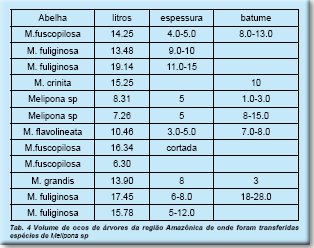
Os volumes dos ocos com ninhos (n=12) de algumas espécies de Melipona da região Amazônica estão identificados na Tab. 4. O valores variaram de 7.3-19.1L, sendo os maiores para M. grandis e M.fuliginosa. A espessura da parede dos troncos variou entre 3-15cm e a do batume entre 1.0-28cm.
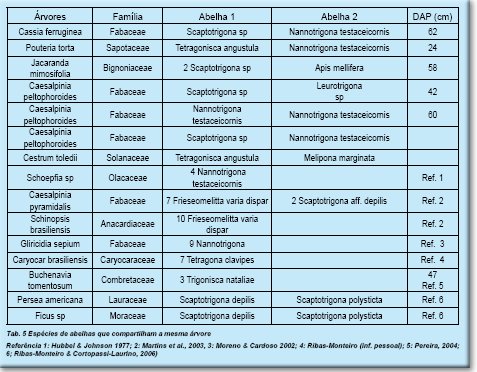
Em várias árvores com oco, ocorre o compartilhamento de espécies iguais ou diferentes (Tab. 5).
Discussão
1.Disponibilidade de ocos
A presença de ocos, em muitos casos, parece ser uma característica dos gêneros ou mesmo das espécies de árvores, como regra em todos os seus representantes. Em outros casos, o oco aparece ocasionalmente, ou muito raramente. Em território brasileiro, o interesse pelo mercado de madeiras tropicais proporcionou maior número de pesquisas nas árvores da floresta Amazônica fornecendo dados sobre espécies com ocos, localização e respectivos volumes. Assim, as florestas de igapós com solo arenoso e florestas de terra firme, apresentaram ambas porcentagens entre 10-38% de árvores ocadas, e com ocos localizados com mais freqüência na sua base (Rodrigues & Valle, 1964; Brown et al., 1995; Apolinário & Martius, 2004; Nogueira et al., 2006). Nesta região, as famílias que apresentaram maior porcentagem de ocos são as Lecythidaceae, Mimosaceae, Celastraceae, Combretaceae e Papilionaceae (Apolinário & Martius, 2004).
2.Famílias e gêneros botânicos mais utilizados
O resultado geral de vários levantamentos e observações esparsas organizado na Fig.1 demonstram que as famílias Fabaceae e Anacardiaceae são as mais observadas com Meliponini nidificando nos seus ocos. Este resultado pode ser conseqüência de maior disponibilidade destas árvores, da maior incidência de ocos e ainda de preferência por parte das espécies de abelhas. Entretanto, quando o foco é pontual, por bioma, ocorrem alterações e certa restrição arbórea.
Em remanescentes de Mata Atlântica, um levantamento específico feito por Batista, 2003 encontrou que as árvores mais representadas com ninhos de abelhas eram as Anacardiaceae (Tapirira guianensis) e Myrsinaceae (Cybianthus sp.). T. guianensis é árvore de madeira leve (0.51g/cm³) de baixa resistência ao ataque de organismos xilófagos (Lorenzi 1992).
Numa região de savana arbórea e bosque úmido amazônico ao norte de La Paz, Copa-Alvaro (2004) encontrou 85 dos 100 ninhos recenseados de T.angustula em árvores de Astronium urundeuva , também da família Anacardiaceae.
Em área de cerrado, Antonini & Martins (2003) encontraram 46 ninhos de Melipona quadrifasciata em 48 espécimes de Caryocar brasiliensis (Caryocaraceae), sugerindo uma seleção ativa das árvores. Entretanto, segundo Ratter et al. (2003), esta espécie ocorre em 50% das 376 áreas de cerrado avaliadas, o que demonstra a sua ampla dispersão e conseqüentemente, uma possível grande oferta de ocos para animais.
Em região de caatinga, Martins et al. (2004) observaram nítida predominância de M.subnitida em troncos de Commiphora leptophloeos (50.0%; n=130) e de M. asilvai em troncos de C. pyramidalis (92.3%; n=39).
Sobre os gêneros mais citados como locais de nidificação, como observados na Fig.2, Tabebuia é gênero que apresenta grande gama na densidade das suas madeiras, desde muito leve (0.39g/cm³) até pesada (1.08g/cm³), sendo as mais leves as de baixa durabilidade sob condições naturais. São árvores pioneiras. As Caesalpinia apresentam madeiras pesadas e moderadamente pesadas com média e longa durabilidade natural. Salvertia são moderadamente pesadas, mas com baixa durabilidade quando expostas às intempéries. Commiphora leptophloeos é espécie de densidade leve (0.43g/cm³) e suscetível ao apodrecimento e os Ficus são moderadamente pesados, mas pouco resistes e de baixa durabilidade natural (Lorenzi, 1998). Portanto, a baixa durabilidade, ou densidade de muitos destes gêneros poderiam favorecer o aparecimento de ocos pelo ataque de larvas de besouros e cupins, além de outros fatores.
3.Presença de ocos em árvores vivas e mortas
Árvores mortas apresentam maior freqüência de ocos, e árvores maiores (>80cm) têm 55% de chance de serem ocadas, o que as torna preferidas por determinadas espécies de aves e mamíferos (Harper et al. 2005). Algumas espécies de meliponíneos, como Friesella e Frieseomelitta também foram encontradas com freqüência em ocos de árvores mortas como mourões de cerca, fato que pode estar associado com a organização em forma de cachos das células de cria e ou a capacidade de não ser afetada com as flutuações diárias e sazonais da temperatura e umidade. Na literatura, outras espécies também usam ocos de árvores mortas: Copa-Alvaro (2004) citou 42% dos ninhos de T. angustula em troncos caídos ou mortos ao norte de La Paz e Vergara et al.(1986) encontrou duas espécies (6%) nidificando sempre em árvores mortas. Por outro lado, árvores vivas acumulam maior quantidade de água e talvez este atributo de umidade constante seja um fator essencial para que estas abelhas (meliponíneos) se distribuam nas regiões pantropicais (Sakagami, 1982).
4.Abelhas mais amostradas
As abelhas com maior número de referências quanto aos substratos de nidificação foram as do gênero Melipona e Tetragonisca. Certamente as referências estão associadas com o interesse na sua criação pelo mel que produzem e pela ausência de agressividade. Os ninhos de Melipona ( Fig.4, Fig. 5) são os mais produtivos em quantidade de mel e os de Tetragonisca angustula são considerados medicinais com amplo uso por toda América Latina, sua área de dispersão (Cortopassi-Laurino et al. 2006). A facilitação da percepção visual na localização dos ninhos próximos ao solo provavelmente também influenciam nestes resultados.
1.Disponibilidade de ocos
A presença de ocos, em muitos casos, parece ser uma característica dos gêneros ou mesmo das espécies de árvores, como regra em todos os seus representantes. Em outros casos, o oco aparece ocasionalmente, ou muito raramente. Em território brasileiro, o interesse pelo mercado de madeiras tropicais proporcionou maior número de pesquisas nas árvores da floresta Amazônica fornecendo dados sobre espécies com ocos, localização e respectivos volumes. Assim, as florestas de igapós com solo arenoso e florestas de terra firme, apresentaram ambas porcentagens entre 10-38% de árvores ocadas, e com ocos localizados com mais freqüência na sua base (Rodrigues & Valle, 1964; Brown et al., 1995; Apolinário & Martius, 2004; Nogueira et al., 2006). Nesta região, as famílias que apresentaram maior porcentagem de ocos são as Lecythidaceae, Mimosaceae, Celastraceae, Combretaceae e Papilionaceae (Apolinário & Martius, 2004).
2.Famílias e gêneros botânicos mais utilizados
O resultado geral de vários levantamentos e observações esparsas organizado na Fig.1 demonstram que as famílias Fabaceae e Anacardiaceae são as mais observadas com Meliponini nidificando nos seus ocos. Este resultado pode ser conseqüência de maior disponibilidade destas árvores, da maior incidência de ocos e ainda de preferência por parte das espécies de abelhas. Entretanto, quando o foco é pontual, por bioma, ocorrem alterações e certa restrição arbórea.
Em remanescentes de Mata Atlântica, um levantamento específico feito por Batista, 2003 encontrou que as árvores mais representadas com ninhos de abelhas eram as Anacardiaceae (Tapirira guianensis) e Myrsinaceae (Cybianthus sp.). T. guianensis é árvore de madeira leve (0.51g/cm³) de baixa resistência ao ataque de organismos xilófagos (Lorenzi 1992).
Numa região de savana arbórea e bosque úmido amazônico ao norte de La Paz, Copa-Alvaro (2004) encontrou 85 dos 100 ninhos recenseados de T.angustula em árvores de Astronium urundeuva , também da família Anacardiaceae.
Em área de cerrado, Antonini & Martins (2003) encontraram 46 ninhos de Melipona quadrifasciata em 48 espécimes de Caryocar brasiliensis (Caryocaraceae), sugerindo uma seleção ativa das árvores. Entretanto, segundo Ratter et al. (2003), esta espécie ocorre em 50% das 376 áreas de cerrado avaliadas, o que demonstra a sua ampla dispersão e conseqüentemente, uma possível grande oferta de ocos para animais.
Em região de caatinga, Martins et al. (2004) observaram nítida predominância de M.subnitida em troncos de Commiphora leptophloeos (50.0%; n=130) e de M. asilvai em troncos de C. pyramidalis (92.3%; n=39).
Sobre os gêneros mais citados como locais de nidificação, como observados na Fig.2, Tabebuia é gênero que apresenta grande gama na densidade das suas madeiras, desde muito leve (0.39g/cm³) até pesada (1.08g/cm³), sendo as mais leves as de baixa durabilidade sob condições naturais. São árvores pioneiras. As Caesalpinia apresentam madeiras pesadas e moderadamente pesadas com média e longa durabilidade natural. Salvertia são moderadamente pesadas, mas com baixa durabilidade quando expostas às intempéries. Commiphora leptophloeos é espécie de densidade leve (0.43g/cm³) e suscetível ao apodrecimento e os Ficus são moderadamente pesados, mas pouco resistes e de baixa durabilidade natural (Lorenzi, 1998). Portanto, a baixa durabilidade, ou densidade de muitos destes gêneros poderiam favorecer o aparecimento de ocos pelo ataque de larvas de besouros e cupins, além de outros fatores.
3.Presença de ocos em árvores vivas e mortas
Árvores mortas apresentam maior freqüência de ocos, e árvores maiores (>80cm) têm 55% de chance de serem ocadas, o que as torna preferidas por determinadas espécies de aves e mamíferos (Harper et al. 2005). Algumas espécies de meliponíneos, como Friesella e Frieseomelitta também foram encontradas com freqüência em ocos de árvores mortas como mourões de cerca, fato que pode estar associado com a organização em forma de cachos das células de cria e ou a capacidade de não ser afetada com as flutuações diárias e sazonais da temperatura e umidade. Na literatura, outras espécies também usam ocos de árvores mortas: Copa-Alvaro (2004) citou 42% dos ninhos de T. angustula em troncos caídos ou mortos ao norte de La Paz e Vergara et al.(1986) encontrou duas espécies (6%) nidificando sempre em árvores mortas. Por outro lado, árvores vivas acumulam maior quantidade de água e talvez este atributo de umidade constante seja um fator essencial para que estas abelhas (meliponíneos) se distribuam nas regiões pantropicais (Sakagami, 1982).
4.Abelhas mais amostradas
As abelhas com maior número de referências quanto aos substratos de nidificação foram as do gênero Melipona e Tetragonisca. Certamente as referências estão associadas com o interesse na sua criação pelo mel que produzem e pela ausência de agressividade. Os ninhos de Melipona ( Fig.4, Fig. 5) são os mais produtivos em quantidade de mel e os de Tetragonisca angustula são considerados medicinais com amplo uso por toda América Latina, sua área de dispersão (Cortopassi-Laurino et al. 2006). A facilitação da percepção visual na localização dos ninhos próximos ao solo provavelmente também influenciam nestes resultados.
Fig.4 Entrada de um ninho de Melipona fuscopilosa na região do Xapuri-Acre construído dentro de oco de árvore.
Foto de Marilda Cortopassi-Laurino
Fig.5 Distribuição do ninho de Melipona flavolineata dentro de oco de árvore.
Abaixo o batume isola o ninho do oco. Acima a região dos favos e mais acima os potes de alimento.
Foto de Marilda Cortopassi-Laurino
5.Diâmetro da árvore e altura da entrada do ninho
Cada espécie de abelha tem necessidade de um diâmetro mínimo para construção do ninho, provavelmente associado com o tamanho dos favos, termorregulação ou ainda com o tipo de agrupamento de células de cria, visto que células em cacho são mais plásticas em relação ao espaço ocupado do que as normalmente construídas em favos horizontais. Assim, para abelhas com favos horizontais, o menor diâmetro da árvore foi de 24cm para a espécie T.angustula e N.testaceicornis; de 33 para T.clavipes e de 27 para P.droryana. Em outras abelhas foi 17 para M. beecheii, 18 para M. compressipes e 17 para Scaptotrigona sp (van Veen & Arce 1999; Moreno & Cardoso 2002).
Para as abelhas que constroem células em cacho o diâmetro mínimo variou de 6-18cm (Leurotrigona, F.silvestrii e F. schrottkyi). Para Batista (2003), o menor diâmetro de árvore encontrado foi onde F.doederleini nidificava: 19.1cm, enquanto para Martins et al. (2004) a mesma espécie utilizou diâmetro mínimo de 9cm e F.varia de 10cm. Embora os diâmetros dos favos com células em cacho sejam, como regra geral, menores do que o outro grupo, o de favos horizontais, mais dados precisam ser obtidos para confirmação desta preferência. Já foi sugerido que abelhas com células em cacho seriam as mais capacitadas para o povoamento de estágios iniciais de áreas em recuperação (Hubbell & Johnson, 1977). No nosso caso, pelo menos as três espécies com células em cacho citadas anteriormente poderiam ser indicadas para tal atividade.
As observações da altura da entrada dos ninhos podem estar relacionadas à facilidade em encontrá-los. T.angustula, muito comum em áreas urbanas, distribui-se em até dois metros de altura, enquanto Plebeia sp, de população e tamanho semelhantes, ficam em alturas maiores (2.0-4.0m) e são menos freqüentes. Entretanto, Copa-Alvaro (2004) que encontrou 71 ninhos de T.angustula anotou que eles também se distribuíam em baixas altitudes, de até 0.33m de altura na região norte da cidade de La Paz-Bolívia, o que sugere uma característica para esta espécie. Esta mesma autora citou 14 ninhos de Melipona rufiventris distribuídos em até 2.15m de altura, enquanto do mesmo gênero, M. scutellaris apresenta entrada dos ninhos entre 2.2-4.1m (Batista, 2003).
Em relação ao substrato que utilizam, algumas abelhas são mais versáteis enquanto outras são mais específicas. Assim, dos poucos meliponíneos (6 espécies) que sobrevivem em áreas urbanas, a T. angustula é a principal delas e seu sucesso está relacionado além da sua politrofia (Cortopassi-Laurino, 2005) ao uso de fendas em muros e outras construções, caixas de medição de energia, e ocos de árvores como local de nidificação. Na região de São Paulo, em bairro arborizado, onde foram observados 21 ninhos desta abelha, o dobro de ninhos foi encontrado em construções humanas (66.7%) do que em abrigos naturais (33.3%).
Ninhos aéreos como os de T.spinipes e T.hyalinata apresentam-se em diferentes alturas respectivamente entre 3-15m e 3-7m. Curiosamente, dois ninhos desta última continuaram ativos por anos no solo, após a sua queda de árvores onde estavam fixados. Para ambas as espécies, a maioria das árvores onde se fixavam apresenta caducifólia no período mais seco e frio do ano, aumentando a exposição dos ninhos ao calor e a luminosidade. T.hyalinata pode também ser encontrada em edificações, e nestas, em alturas até 4m.
Quanto a T.spinipes, a construção de ninhos aéreos (Fig. 6) com média de 7.4m de altura, é fator que favorece a sua sobrevivência em áreas urbanas. Um dos ninhos está localizado atrás do MASP (Museu de Arte de São Paulo), na Avenida Paulista, um centro financeiro da cidade com muitos prédios.

Fig. 6 Ninho de Trigona spinipes (irapuá) entre os ramos de paineira (Chorisia speciosa).
Esta espécie usa a arvore como suporte para a construção do ninho e não o seu oco como a maioria das espécies de meliponíneos.
Foto de Marilda Cortopassi-Laurino
6.Volume dos ocos
O tamanho da populacão dos ninhos e das abelhas varia bastante entre os meliponíneos (Roubik, 1989) indicando diferentes necessidades de espaço para nidificar. Assim, um pequeno volume era suficiente para um ninho de Leurotrigona sp. que se distribuía ao longo de um tronco de cajazinho (Myrtaceae) com 5-6cm de diâmetro e outro que não ocupava mais que 0.5L de uma caixa racional, dados que confirmam os de Roubik (1983) onde cavidades de 1-5cm já são usadas pelos menores meliponíneos. No outro extremo, as espécies e abelhas grandes do gênero Melipona, como M. grandis e M. fuliginosa, ocupam volumes de quase 20L, embora espécies menores como M.subnitida usam ocos de 5.6L e M. beecheii de 10.0L (van Veen & Arce 1999; Martins et al., 2003).

Quando ocorre do oco ser maior que o necessário, as abelhas isolam o espaço com uma parede de batume, como já foi observado para Leurotrigona, Tetragonisca angustula e Nannotrigona testaceicornis, esta última construindo uma parede muito fina mas podendo ser muito dura, de batume perfurado. No caso das abelhas Melipona da região Amazônica, a parede muito espessa de batume pode atingir até 28cm.
7.Compartilhamento de árvores por abelhas sem ferrão
A presença de vários ninhos de Meliponini na mesma árvore pode indicar espécies de abelhas não agressivas, como Nannotrigona ou Plebeia sp ou entradas construídas fora do território da outra espécie, pois nas nossas observações, as entradas estavam quase sempre em alturas diferentes ou direções opostas. Um caso de Apis mellifera e Scaptotrigona sp e outro de duas espécies de Scaptotrigona tinham as entradas que estavam há poucos centímetros de distancia.
As observações e citações feitas sugerem a utilização de ocos em uma mesma árvore por várias espécies de abelhas é comum e mais associado com árvores maiores (diâmetros medidos de 24-62), e provavelmente mais velhas, quando o tamanho de oco é maior. Se esta situação está associada com redução de locais de nidificação, só estudos mais pontuais poderão confirmar, entretanto, este era o caso citado por Martins et al.(2003), na região da caatinga.
Agradecimentos
Agradecemos ao apoio financeiro da FAPESP (04/15801-0; 05/58093-8) e do CNPq (311381/2006-5;) para a realização deste trabalho. Um agradecimento especial ao Dr. Paulo Nogueira Neto, que nos recebeu no meliponário de Xapuri, e ao Juvenal Flores, pelo suporte dos trabalhos de campo.
Referências Bibliográficas
Antonini, Y & Martins, R.P. 2003 The value of a tree species (Caryocar brasiliense) for a stingless bee Melipona quadrifasciata quadrifasciata . J. Insect Conservation 7(3):167-174
Apolinário, F.E. & Martius, C. 2004 Ecological role of termites (Insecta, Isoptera) in tree trunks in central Amazonian rain forests. Forest Ecol. Management 194:23-28.
Batista, M.A. 2003 Distribuição e dinâmica especial de abelhas sociais Meliponini em um remanescente de Mata Atlântica (Salvador, Bahia) dissertação. Depto de Biologia. FFCLRP da USP-Ribeirão Preto-SP
Brown, I.F.,Martineli, L.A., Thomas, W., Moreira, M.Z., Ferreira, C.A. & Vitoria, R.A. 1995 Uncertainty in the biomass of Amazonian forests: an example from Rondônia, Brazil. Forest Ecol. Management 75:175-189.
Carrit, R. 1999 Natural Tree Hollows essencial for wildlife. Conservation Management serie 5, NSW National Park and Wildlife Services. Sydney Austrália.
Castro, M.S. 2001 A comunidade de abelhas (Hymenoptera; Apoidea) de uma área de caatinga arbórea entre os Inselbergs de Milagres (12º53'S; 39º51'W), Bahia. Tese de Doutoramento: Universidade de São Paulo.
Copa-Alvaro, M. 2004 Patrones de nidificación de Trigona (Tetragonisca) angustula y Melipona rufiventris (Hymenoptera: Meliponini) en el norte de la Paz, Bolivia. Ecol. apl. [online]. jan./dic. 2004, vol.3, no.1-2 [citado 07 Abril 2008], p.82-86. Disponível naWorldWideWeb:http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1726-22162004000100011&lng=pt&nrm=iso. ISSN 1726-2216.
Cortopassi-Laurino, M. 2005 A abelha jataí: uma espécie bandeira? (Tetragonisca angustula Latreille 1811). Mensagem Doce 80 (http://apacame.org.br/mensagemdoce/80artigo.htm ).
Cortopassi-Laurino, M.; Imperatriz-Fonseca, V.L., Roubik, D.W., Dollin, A., Heard, T., Aguilar, I., Venturieri, G.C., Eardley, C. & Nogueira-Neto, P. 2006 Global Meliponiculture: challenges and opportunities. Apidologie 37: 275-292.
Darchen, R. 1972 Écologie de quelques trigones (Trigona sp) de la savane de Lamto (Cote d'Ivoire). Apidologie 3(4): 341-367.
Freitas, G.S. 2001. Levantamento de ninhos de meliponíneos (Hymenoptera, Apidae) em área urbana: Campus da USP, Ribeirão Preto/SP. Dissertação: Universidade de São Paulo.
Harper, M.J., McCarthy, M.A., Ree, R. 2005. The abundance of hollow-bearing trees in urban dry sclerophyll forest and the effect of wind on hollow development. Biological Conservation 122(2): 181-192.
Hubbell S.P. & Johnson L.K. 1997. Competition and nest spacing in a tropical stingless bee community. Ecology. 58: 949-963.
Gibbons, P. & Lindenmayer, D.B. 1997 Conserving hollows-dependent fauna in timber -production forests. Environmental Monographs Series 3, NSW National Park and Wildlife Services. Sydney Austrália.
Kerr, W.E., Sakagami, S.F., Zucchi, R., Portugal-Araujo, V & Camargo, J.M.F 1967 Observações sobre a arquitetura dos ninhos e comportamento de algumas espécies de abelhas sem ferrão das vizinhanças de Manaus, Amazonas (Hymenoptera: Apoidea). Atas Simp. Biota Amazônica 5 (zoologia): 255-309
Lorenzi, H. 1992 Árvores Brasileiras. Editora Plantarum, Nova Odessa-SP, 368p.
Lorenzi, H. 1998 Árvores Brasileiras.Vol.2 Editora Plantarum, Nova Odessa-SP, 368p.
Martins, C. F., Cortopassi-Laurino, M., Koedam, D. & Imperatriz-Fonseca V. L. 2003 The use of tree for nesting by stingless bees in Brazilian Caatinga (Seridó,PB;João Camara,RN)BiotaNeotrópicav4(2):http://biotaneotropica.org.br/v4n2/en/abstract?article+BN00104022004.
Moreno F.A. & Cardozo A.F. 1997. Abundancia de abejas sin aguijón (Meliponinae) en especies maderables del estado de Portuguesa, Venezuela. Vida Silvestre Neotropical. 6 (1-2): 53-56.
Moreno F.A. & Cardozo A.F. 2002 Parametros biométricos y estados de colônias de abejas sin aguijon (Meliponinae) en restos de árboles después de la explotación maderera em el estado Portuguesa-Venezuela. Livertock Research for Rural Development 14:1-6.
Nogueira, E.M.; Nelson, B.W. & Fearnside, P.M. 2003 Volume and biomass of trees in central Amazonia: influence of irregularly shaped and hollow trunks. Forest Ecology and Management 194: 14-21.
Pereira, U.C.R. 2004. Ninhos de Meliponinae (Hymenoptera, Apidae) do Parque Municipal do Bacaba, Nova Xavantina-MT. Monografia: Universidade do Estado do Mato Grosso.
Proença, C.C., Oliveira, R.S. & Silva. A.P. 2006 Flores e Frutos do Cerrado- Guia de Campo Ilustrado. Instituto do Cerrado Editora- Brasília 226p.
Ribas-Monteiro, W. & Cortopassi-Laurino, M. 2006 Visita Técnica a Icém-SP. Mensagem Doce 85 (http://apacame.org.br/mensagemdoce/85/visita_tecnica.htm).
Rassmussen, C. 2004 A Stingless Bee Nesting with a Paper Wasp (Hymenoptera: Apidae, Vespidae) J. Kansas Entomol. Soc. 77(4): 593-601.
Rodrigues, W.A. & Valle, R.C. 1964 Ocorrência de troncos ocos em Mata de baixio da região de Manaus, Amazonas. Pub. 16, Botânica, Instituto Nacional de Pesquisas da Amazônia, Manaus, Amazonas, Brasil. 8p.
Roubik, D.W. 1983 Nest and Colony characteristics of stingless bees from Panama (Hymenoptera, Apidae). J. Kansas Entomol. Soc. 56:327-355.
Roubik D. 1989. Ecology and natural history of tropical bees. Cambridge. University Press, Cambridge, 514 pp
Ratter, J. A., Bridgewater, S.; Ribeiro, J. F. 2003 Analysis of the floristic composition of the Brasilian Cerrado Vegetation III: comparison of the wood vegetation of 376 areas. Edinburgh Journal of Botany 60: 57-109.
Sakagami, S.F 1982 Stingless bees In: Hermann, H.R. (ed.) Social Insects. New York, Academic Press p: 362-423.
van Veen, J.W. & Arce, H.G.A. 1999 Nest and colony characteristics of log-hived Melipona beecheii (Apidae, Meliponinae). J. Apic. Res. 38(1-2): 43-48.
Vergara, C., Villa, A. & Nates, G. 1986 Nidificación de meliponineos (Hymenoptera: Apidae) de la region central de Colômbia. Rev. Biol. Trop. 34 (2): 181-184.

Nenhum comentário:
Postar um comentário